Spain
August 7, 2020

Yolanda Bel, Patricia Casino, Joan Ferré i Juan José Huesa
A team from Valencia University has taken part in research that will improve plague control in agriculture.
A research team of Valencia University, ERI Biotecmed, along with researchers from the Centre for Biological Research (CIB) of the Spanish National Research Council (CSIC) and the rare disease CIBER, CIBERERE-ISCIII, have proved, for the first time, the structure of insecticidal protein Vip3Aa, as well as the changes experienced to go from its inactive structure (‘protoxin’) to its active structure (‘toxin’). The results of this work have been published in journal Nature Communications.
Revelen el mecanisme d'activació de la proteïna insecticida Vip3A que ajudarà a desenvolupar biopesticides més efectius
Vip3Aa is an insecticidal protein secreted by bacterium Bacillus thuringiensis that has effective action against a broad spectrum of lepidoptera insects. Today, it is used in ecological and conventional crops as a spray biopesticide (Bt insecticides), as well as in transgenic crops protected against the attack of insects (Bt crops). However, the mechanism that induced the insecticidal action of Vip3Aa remained unknown.
“Our contribution helps understand how Vip3 proteins act to destroy the epithelial cells of the midgut of insect larvae, which ultimately lead to their death,” explain Joan Ferré and Yolanda Bel, researchers of Valencia University.
This project presents a turning point in the study of the insecticidal action of Vip3Aa and opens the door to the development of new biotechnological applications, such as protein engineering, which make it possible to produce more stable proteins and with greater activity in order to control agricultural plagues.
“It is worth noting that this is the first structure of a protein, at atomic resolution, obtained through electronic cryo-electron microscopy at Valencia University, a new technique that is gaining traction and has a lot to offer together with crystallography,” says Patricia Casino, ‘Ramón y Cajal’ researcher at Valencia University.
Structural study of protein Vip3A
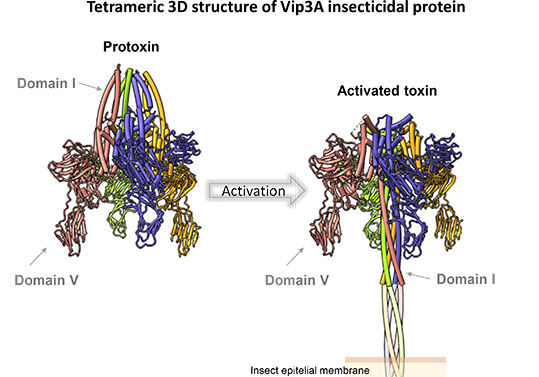
The study conducted makes it possible to view the structure of insecticidal protein Vip3Aa, as well as the changes experienced to go from its inactive structure (‘protoxin’) to its active structure (‘toxin’).
The structural study conducted shows that the protoxin is a tetramer of pyramidal structure, where the N-terminal region sticks out and creates a ray of twisted helixes, and the C-terminal region stretches out in the opposite direction, revealing a branched appearance. The protoxin has a cleavage site exposed to the solvent that is recognised by proteases, which cause a cut that will facilitate the transformation of protoxin into toxin. This process entails a dramatic restructuring of the N-terminal region and gives way to the creation of a parallel coiled coil of four helixes with the appearance of a needle. This needle, of almost 160 Å, is long enough to penetrate the insect’s membrane and contribute to the toxic effect. Although for some time it has been known that the proteins of the Vip3 family are found in a solution in the form of a tetramer, there had never before been a structural image of the changes that led from the protoxin structure to the active form. Thus, now it is understood how the Vip3 proteins work to destroy insect larvae. This paper will enable the development of new biotechnological applications to produce more stable insecticides in order to control agricultural plagues.
Article of reference:
Núñez-Ramírez R, Huesa J, Bel Y, Ferré J, Casino P* and Arias-Palomo* E.
Molecular architecture and activation of the insecticidal protein Vip3Aa from Bacillus thuringiensis.
doi: 10.1038/s41467-020-17758-5
Revelen el mecanisme d'activació de la proteïna insecticida Vip3A que ajudarà a desenvolupar biopesticides més efectius
Un equip d'investigació de la Universitat de València-ERI Biotecmed, juntament amb investigadores i investigadors del Centre d'Investigacions Biològiques (CIB) del Consell Superior d'Investigacions Científiques (CSIC) i el CIBER de malalties rares CIBERERE-ISCIII, han mostrat, per primera vegada, l'estructura de la proteïna insecticida Vip3Aa, així com els canvis patits per a passar de la seua conformació inactiva (‘protoxina’) a la seua conformació activa (‘toxina’). Els resultats d'aquest treball han sigut publicats en la revista Nature Communications.
Vip3Aa és una proteïna insecticida secretada pel bacteri Bacillus thuringiensis que presenta una potent acció enfront d'un ampli espectre d'insectes lepidòpters. Hui en dia, s'utilitza tant en cultius ecològics i convencionals com biopesticides de polvorització (insecticides Bt), així com en cultius transgènics protegits contra l'atac d'insectes (cultius Bt). No obstant això, es desconeixia el mecanisme pel qual Vip3Aa induïa la seua acció insecticida.
“La nostra aportació ajuda a comprendre com actuen les proteïnes Vip3 a l'hora de destruir les cèl·lules epitelials de l'intestí mitjà de les larves dels insectes, que conduïxen finalment a la seua mort”, expliquen Joan Ferré i Yolanda Bel, investigadors de la Universitat de València.
Aquest treball presenta un punt d'inflexió en l'estudi de l'acció insecticida de Vip3Aa i obri la porta al desenvolupament de noves aplicacions biotecnològiques, com l'enginyeria de proteïnes, que permeta produir proteïnes insecticides més estables i amb major activitat per al control de plagues de l'agricultura.
“Cal destacar que aquesta és la primera estructura d'una proteïna, a resolució atòmica, obtinguda mitjançant crio-microscòpia electrònica a la Universitat de València, una nova tècnica que s'obri pas i que té molt a oferir juntament amb la cristal·lografia”, comenta Patrícia Casino, investigadora ‘Ramón y Cajal’ de la Universitat de València.
Estudi Estructural de la proteïna Vip3A
L'estudi realitzat permet mostrar l'estructura de la proteïna insecticida Vip3Aa, així com els canvis patits per a passar de la seua conformació inactiva (‘protoxina’) a la seua conformació activa (‘toxina’).
L'estudi estructural dut a terme demostra que la protoxina és un tetràmer d'aspecte piramidal, on la regió N-terminal protrudix i forma un feix d'hèlices retorçudes i la regió C-terminal s'estén en direcció oposada donant un aspecte ramificat. La protoxina presenta un lloc de tall exposat al solvent que és reconegut per proteases, les quals produiran un tall que facilitarà la conversió de protoxina en toxina. Aquest procés comporta una reestructuració dramàtica de la regió N-terminal i dóna lloc a la formació d'un entrellaçat (coiled-coil) paral·lel de quatre hèlices amb aspecte d'agulla. Aquesta agulla, de quasi 160 Å, té una longitud suficient per a penetrar en la membrana de l'insecte i contribuir a aquest efecte tòxic. Encara que des de feia temps se sabia que les proteïnes de la família Vip3 es trobaven en solució en forma de tetràmer, mai abans s’havia tingut una visió estructural dels canvis que conduïen de la forma de protoxina a la forma activada. Així, ara es comprén com actuen les proteïnes Vip3 per a destruir les larves dels insectes. Aquest treball permetrà el desenvolupament de noves aplicacions biotecnològiques per a produir insecticides més estables per al control de plagues en l'agricultura.
Article de referència:
Núñez-Ramírez R, Huesa J, Bel Y, Ferré J, Casino P* and Arias-Palomo* E.
Molecular architecture and activation of the insecticidal protein Vip3Aa from Bacillus thuringiensis.
Desvelan el mecanismo de activación de la proteína insecticida Vip3A que ayudará a desarrollar biopesticidas más efectivos
Un equipo de investigación de la Universitat de València-ERI Biotecmed, junto con investigadoras e investigadores del Centro de Investigaciones Biológicas (CIB) del Consejo Superior de Investigaciones Científicas (CSIC) y el CIBER de enfermedades raras CIBERERE-ISCIII, han mostrado, por primera vez, la estructura de la proteína insecticida Vip3Aa, así como los cambios sufridos para pasar de su conformación inactiva (‘protoxina’) a su conformación activa (‘toxina’). Los resultados de este trabajo han sido publicados en la revista Nature Communications.
Vip3Aa es una proteína insecticida secretada por la bacteria Bacillus thuringiensis que presenta una potente acción frente a un amplio espectro de insectos lepidópteros. Hoy en día, se utiliza tanto en cultivos ecológicos y convencionales como biopesticidas de pulverización (insecticidas Bt), así como en cultivos transgénicos protegidos contra el ataque de insectos (cultivos Bt). Sin embargo, se desconocía el mecanismo por el que Vip3Aa inducía su acción insecticida.
“Nuestra aportación ayuda a comprender cómo actúan las proteínas Vip3 a la hora de destruir las células epiteliales del intestino medio de las larvas de los insectos, que conducen finalmente a su muerte”, explican Joan Ferré y Yolanda Bel, investigadores de la Universitat de València.
Este trabajo presenta un punto de inflexión en el estudio de la acción insecticida de Vip3Aa y abre la puerta al desarrollo de nuevas aplicaciones biotecnológicas, como la ingeniería de proteínas, que permita producir proteínas insecticidas más estables y con mayor actividad para el control de plagas de la agricultura.
“Hay que destacar que esta es la primera estructura de una proteína, a resolución atómica, obtenida mediante crio-microscopía electrónica en la Universitat de València, una nueva técnica que se abre paso y que tiene mucho que ofrecer junto con la cristalografía”, comenta Patricia Casino, investigadora ‘Ramón y Cajal’ de la Universitat de València.
Estudio Estructural de la proteína Vip3A
El estudio realizado permite mostrar la estructura de la proteína insecticida Vip3Aa, así como los cambios sufridos para pasar de su conformación inactiva (‘protoxina’) a su conformación activa (‘toxina’).
El estudio estructural llevado a cabo demuestra que la protoxina es un tetrámero de aspecto piramidal, donde la región N-terminal protrude y forma un haz de hélices retorcidas y la región C-terminal se extiende en dirección opuesta dando un aspecto ramificado. La protoxina presenta un sitio de corte expuesto al solvente que es reconocido por proteasas, las cuales producirán un corte que facilitará la conversión de protoxina en toxina. Este proceso conlleva una reestructuración dramática de la región N-terminal y da lugar a la formación de un entrelazado (coiled-coil) paralelo de cuatro hélices con aspecto de aguja. Esta aguja, de casi 160 Å, tiene una longitud suficiente como para penetrar en la membrana del insecto y contribuir al efecto tóxico. Aunque desde hacía tiempo se sabía que las proteínas de la familia Vip3 se encontraban en solución en forma de tetrámero, nunca antes se había tenido una visión estructural de los cambios que conducían de la forma de protoxina a la forma activada. Así, ahora se comprende cómo actúan las proteínas Vip3 para destruir las larvas de los insectos. Este trabajo permitirá el desarrollo de nuevas aplicaciones biotecnológicas para producir insecticidas más estables para el control de plagas en la agricultura.
Artículo de referencia:
Núñez-Ramírez R, Huesa J, Bel Y, Ferré J, Casino P* and Arias-Palomo* E.
Molecular architecture and activation of the insecticidal protein Vip3Aa from Bacillus thuringiensis.